سلول های بنیادی عضلات اسکلتی (SMSCs)
سلول های بنیادی عضلات اسکلتی (SMSCs)
بلاست های عضلات اسکلتی (سلول های ماهواره ای Satellite Cells) سلول های پیش ساز عضلانی هستند که در لایه بازال فیبر های عضلات بالغین قرار گرفته اند و به واسطه ادغام با سلول های عضلانی قابلیت تمایز به سلول های عضلانی بزرگسال را دارند و منبع مهمی برا ی ترمیم بافت های عضلات اسکلتی هستند.
مزایای سلول های ماهیچه ای
امکان جمع آوری از خود فرد (اتولوگ)/ عدم وجود مشکلات اخلاقی، ایمونولوژیکی و حتی خصوصیات زیست شناختی
امکان تکثیر، تمایز و ایجاد تغییر ژنتیکی آنها در محیط آزمایشگاهی و امکان تمایز آنها به سلول های عضلانی_اسکلتی بعد از پیوند، مقاومت زیاد در مقابل ایسکمی و اثربخش بودن پیوند این سلول ها در بهبود عملکرد عضله قلبی در مطالعات بالینی مهاجرت این سلول ها به موضع و ادغام با فیبر های آسیب دیده و سنتز پروتئین های عضلانی به ویژه بعد از پیوند
عیب: کم بودن میزان پروتئین های 43-connexin وN-cadherin ، در سلول های عضلانی پیوند شده به موضع آسیب دیده قلبی اما تعیین دیسک هایIntercalated بعد از تمایز در موضع (مثلا بوده شرایطی که سلول ها به سلول مورد نظر ما تمایز نیافته بلکه به سلول های ماهیچه ای دیگر تمایز یافته است)
مهم ترین عیب این روش هم کم بودن زمان و فرصت کافی برای فرد است زیرا ممکن است فرد زمان کافی برای این امور را نداشته باشد.
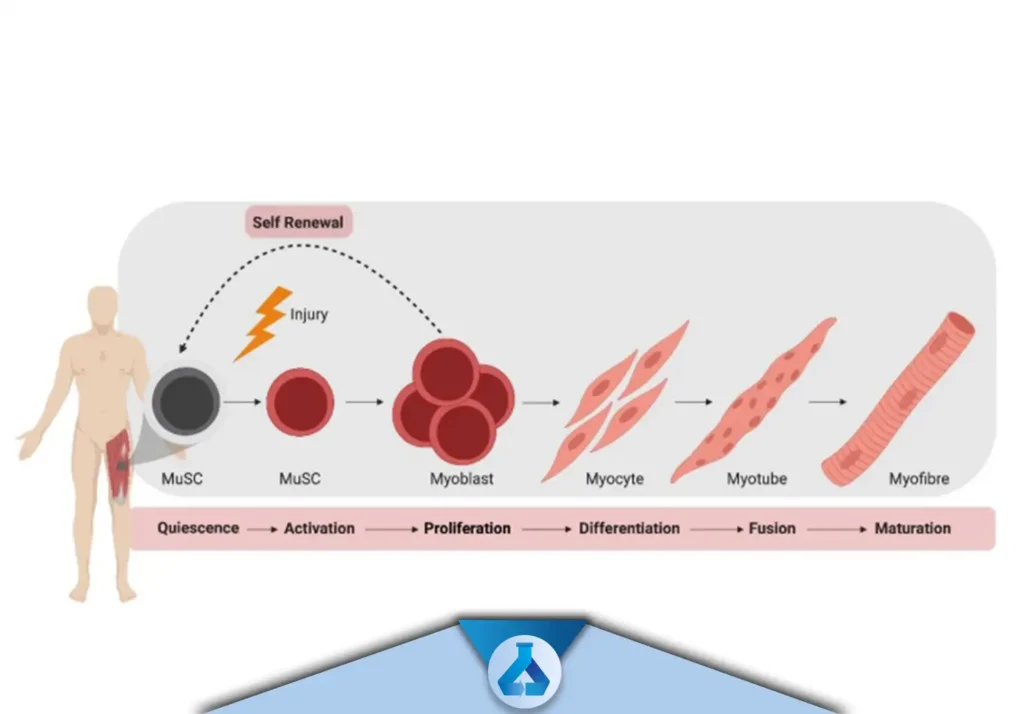
در این شکل علاوه بر توضیحات خود شکل این را هم باید بدانیم که می توان از میوسیت ها (روند بلوغ در بدن فرد صورت گیرد( ومیوفیبر ها) روند بلوغ در آزمایشگاه صورت گیرد) برای پیوند استفاده کرد. گزارش اولین مطالعات بالینی (فازI) استفاده از این سلول ها در ترمیم ضایعات قلبی در سال 2003 بوده است.
علت اصلی در پیشرفت بسیار کند مطالعات بالینی این سلول ها وجود یافته های نگران کننده ای چون:
1. ایجاد ریتم ناهماهنگ ضربان (به علت پروتئین کم)
2 .ایجاد تپش قلب (عارضه کشنده) است.
برای پیشگیری از این ضربان های ناهماهنگ: استفاده از دارو های آمیودارون (یا سایر دارو های این گروه)
سلول های پیش ساز اندوتلیال (Endothelial Precursor Cells)
این سلول ها را برای عروق زایی به همراه سایر سلول ها پیوند می زنند تا روند فرایند به خوبی صورت گیرد.
در مطالعه ای نشان داده شده بعد از ایجاد (infarction Myocardial) MI ، استفاده داخل وریدی این سلول ها سبب:
- لانه گزینی در ناحیه ایسکمیک
- افزایش در تعداد مویرگ ها در حاشیه ناحیه ایسکمیک (به علت القای رگزایی) و عدم مشاهده تغییر در ناحیه غیر ایسکمیک قلب
- کاهش قابل توجه در ذخیره کلاژن و آپوپتوز سلول های عضله قلبی
- تا حدودی تولید سلول های عضله قلبی جدید و بهبود عملکرد قلب
عیب: به دلیل کم بودن تعداد این سلول ها معمولا از روش هایی که امکان تزریق آنها در محل ضایعه است باید استفاده کرد مثل جراحی قلب باز
سلول های بنیادی مزانشیمال (Mesenchymal Stem Cells(MSCs))
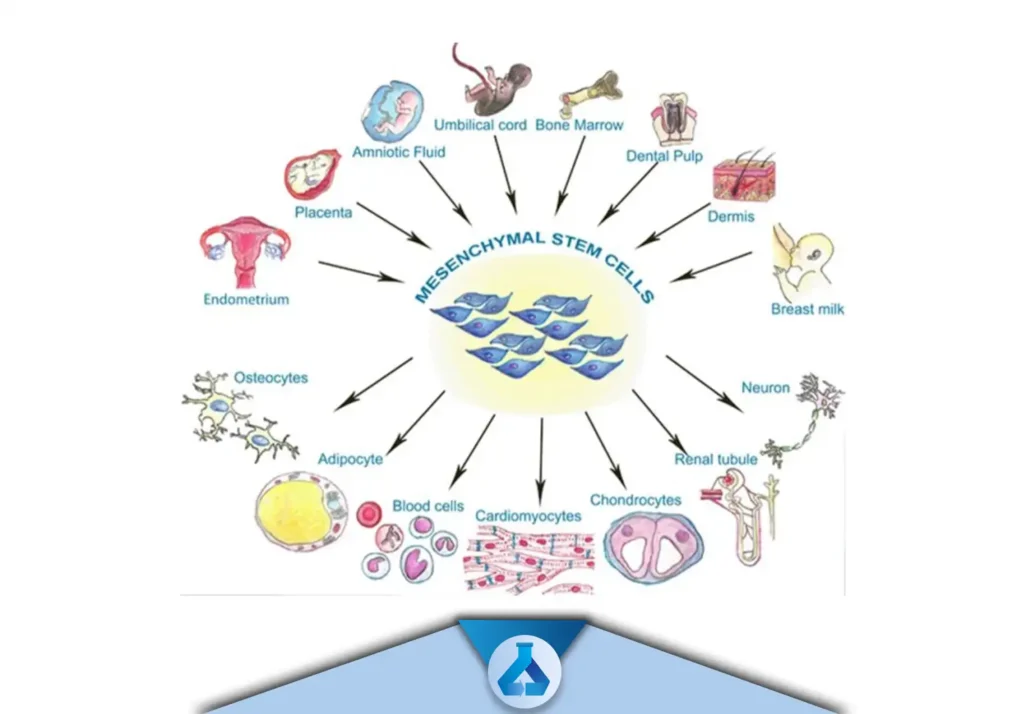
وجود این سلول ها در مغز استخوان، عضله، پوست، بافت چربی و. ..
توانایی رشد و تکثیر نامحدود و تمایز به انواع سلول ها
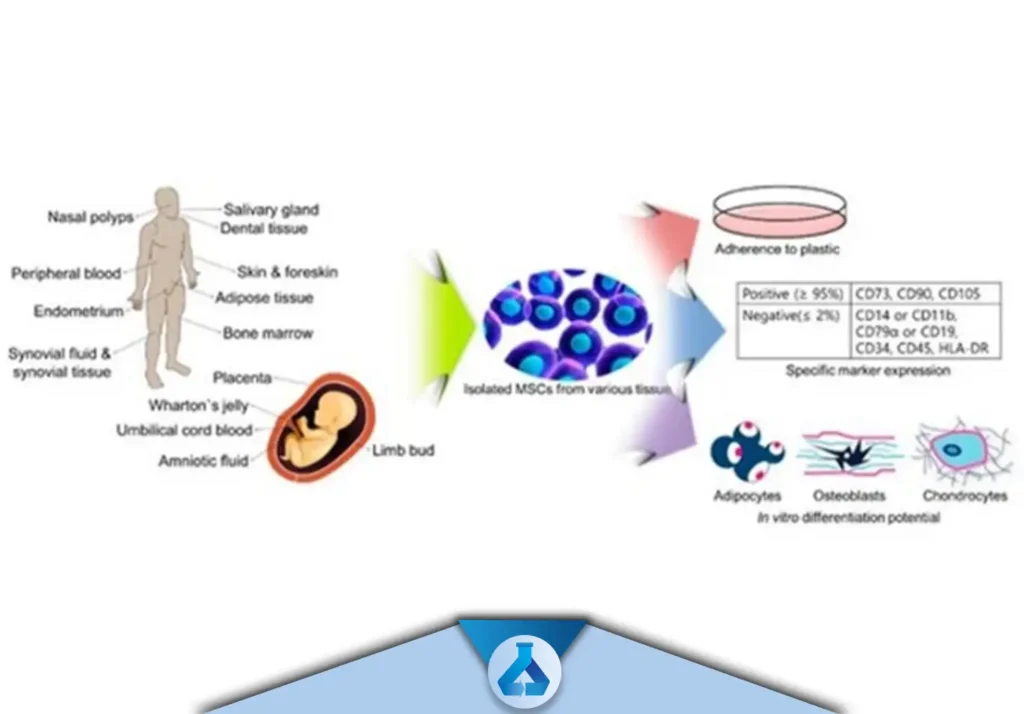
راه های شناسایی سلول های مزانشیمال
- چسبندگی آنها به ظروف کشت/ تبدیل به سلول های عضلانی، چربی، غضروف/ تست های فلوسایتومتری مانند زیر
- CD45 ، c-kit ،CD34 فاقد شاخص های
- CD71 ، CD44 ، CD29 بیان شاخص هایی مثل
- عدم رد پیوند درمان با سلول های مزانشیمی اتولوگ (یکی از ویژگی های خوب)
- استفاده از این سلول ها به عنوان حامل ژن های مورد نظر در درمان بیماری ها (drug delivery) تشخیص محل آسیب دیده و لانه گزینی در آنجا بعد از تزریق سیستمیک
- عملکرد این سلول ها در بیماری های قلبی از طریق تولید سلول های عضله قلبی کارآمد و قابل اتصال به سلول های میزبان و احتمالا رگ های خونی جدید است.
عملکرد سلول های مزاشیمال
- توانایی تمایز این سلول ها به کاردیومیوسیت و ساختارهای شبه رگی
- بدست آوردن فنوتیپ سلول های قلب زمانیکه در عضله قلب کاشته شوند
- بهبود قابل توجه در عملکرد منطقه ای و سراسری بطن چپ
- استفاده همزمان از سلول های مزانشیمی به همراه سلول های پیش ساز اندوتلیال فاقد پتانسیل ایجاد آریتمی در قلب آسیب دیده بعد از پیوند
- درمان با این سلول ها می تواند سبب ترمیم میوکارد آسیب دیده و یا جبران از بد شکل شدن(Remodeling) بطن چپ شود.
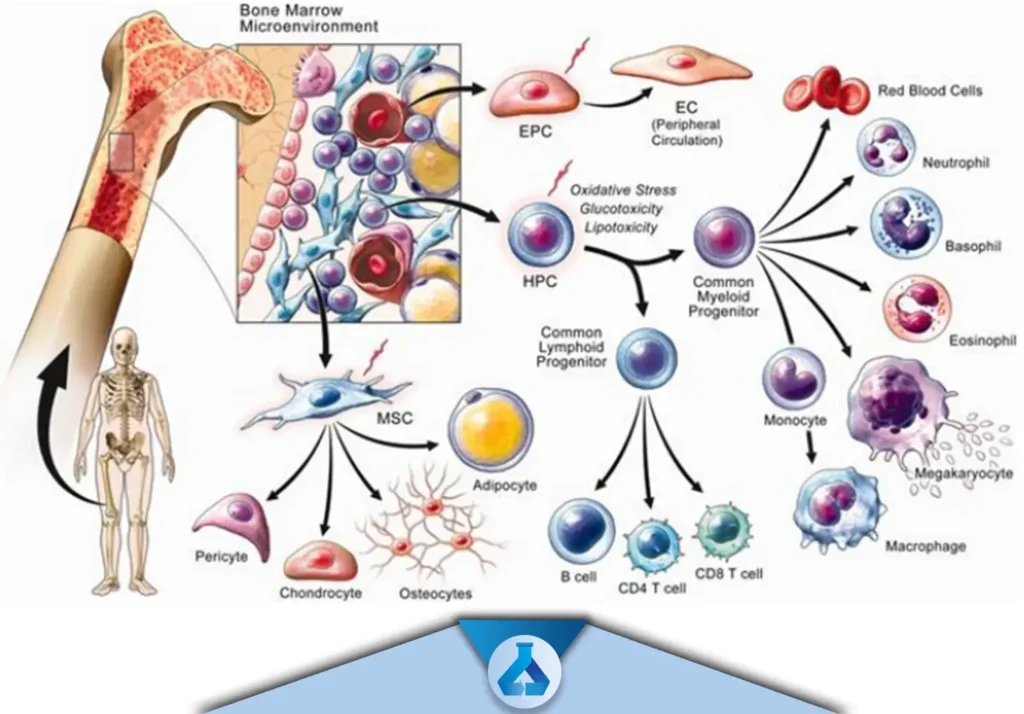
سلول های چربی را از اطراف شکم در انسان، در خرگوش از ناحیه پشت کتف، در گوسفند از ناحیه زیرپوستی و اینگوئینال می گیرند. سلول هایی که تمایزنیافته اند تاثیر کمتری دارند و بیشتر اثرشان در فرد از طریق سیستم پاراکرینی است. سلول های مغز استخوان شامل سلول های بنیادی خون ساز، مزانشیمال، پیش ساز اندوتلیال است.(چندین نوع سلول بنیادی و پیش ساز). عمل پیوند مغز استخوان در بیماران سرطانی هم از همین سلول های مغز استخوانی است که به سلول های خون ساز تبدیل می شود.
مطالعه مقاله ی سلول اپیتلیال و مزانشیمال در سلول های بنیادین
سلول های بنیادی بند ناف (Umbliical Stem Cells(USCs))
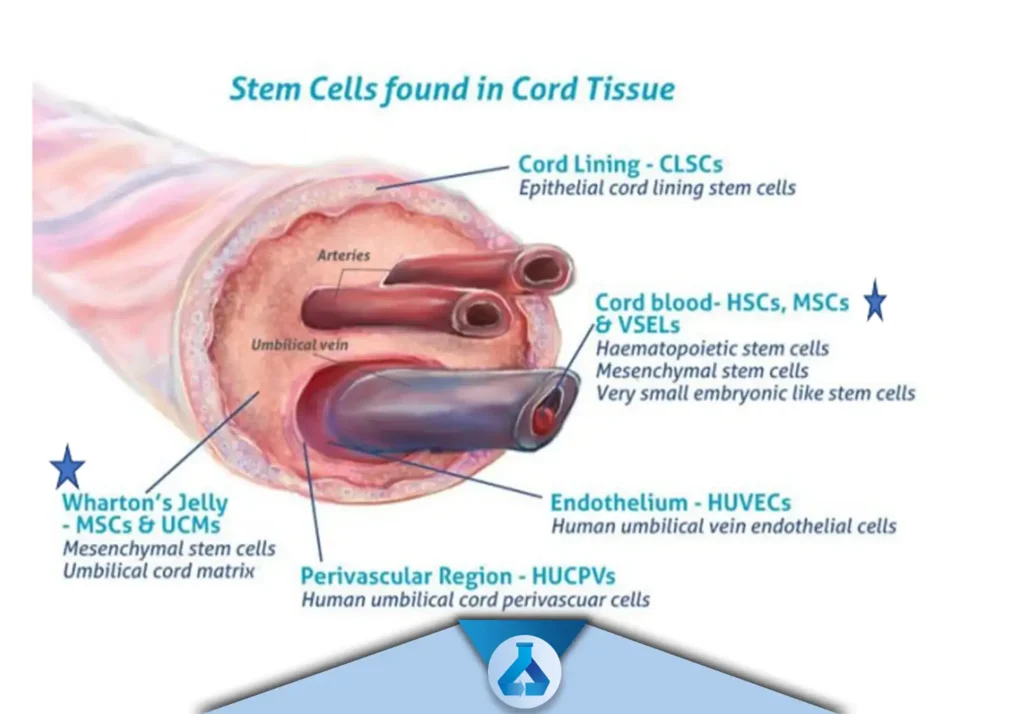
زمانی که نوزاد متولد می شود سلول ها را جداسازی می کنند. روتین ترین قسمت برای جداسازی سلول ها، سلول های خون سیاهرگی بندناف است. بند ناف هم همانند مغز استخوان از چند سلول بنیادی تشکیل شده است این عناوین در شکل بیان شده اند.
وظیفه ی خون بند ناف (UCB)
خون بند ناف دارای هر دو جمعیت سلول های بنیادی خون ساز و مزانشیمال می باشد و وظیفه ی آن:
- جمع آوری آسان و قابلیت تکثیر فراوان این سلول ها و تمایز به انواع سلول ها
- امکان ذخیره آنها را برای استفاده در آینده
- تحریک کمتر سیستم ایمنی نسبت به دیگر سلول ها
- داشتن تعداد بیشتری از سلول های خونساز واجد 133CD و 34
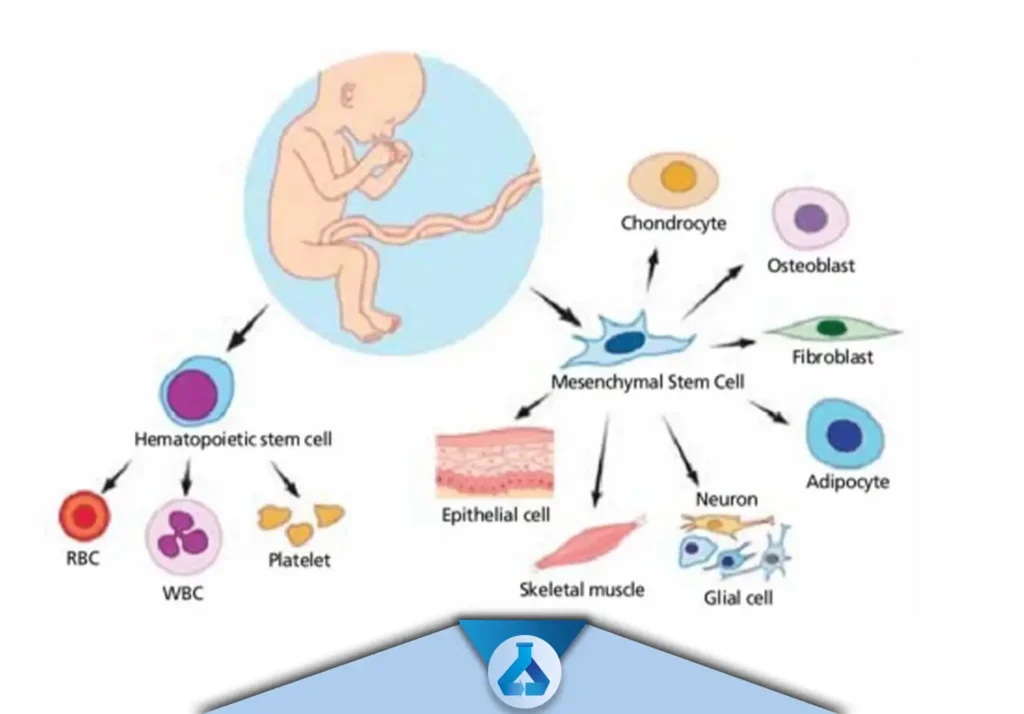
پیوند و اثبات اثر درمانی سلول های بنیادی بند ناف در مدل حیوانی ایسکمیک
اثبات اثر درمانی این سلول ها در مدل حیوانی ایسکمیک بطوری که پیوند این سلول ها سبب:
- کاهش اندازه ناحیه انفارکت
- افزایش رگزایی جدید با سلول های اندوتلیال مویرگی
- بهبود جریان خون و حرکت دیواره قلب
- افزایش عملکرد قلب
روش های پیوند سلول های بنیادی در آسیب های قلبی
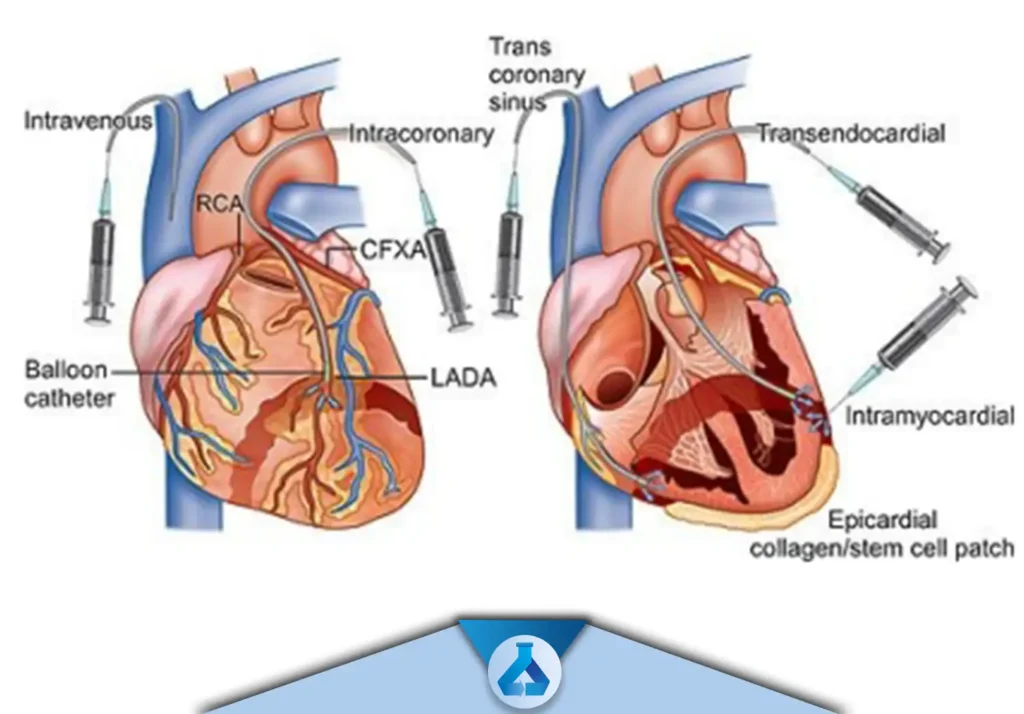
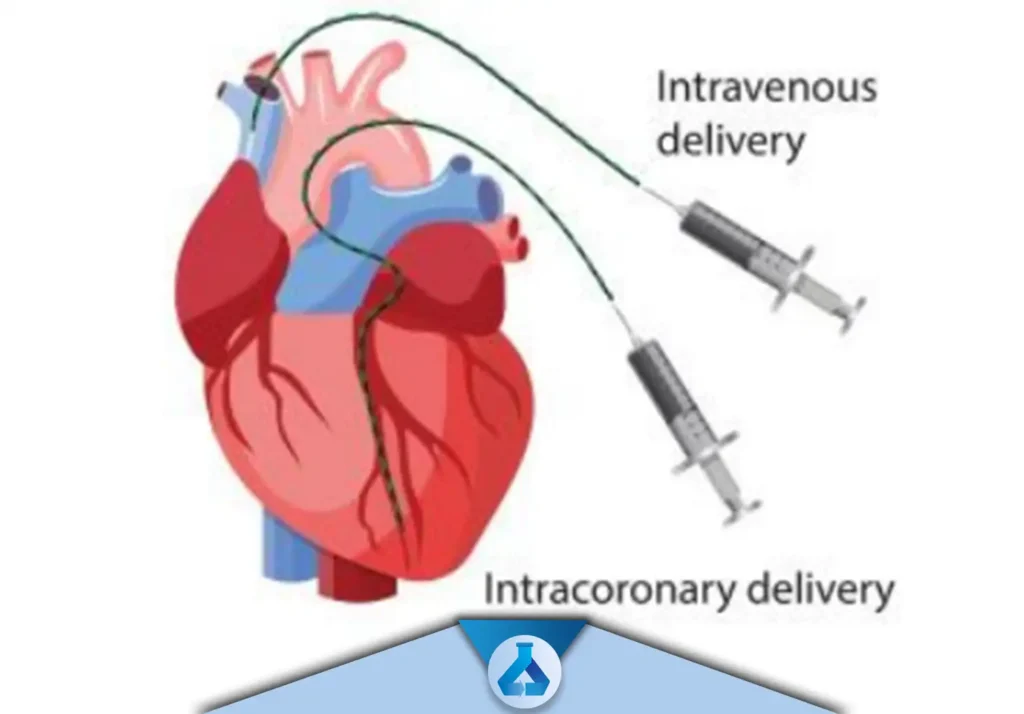
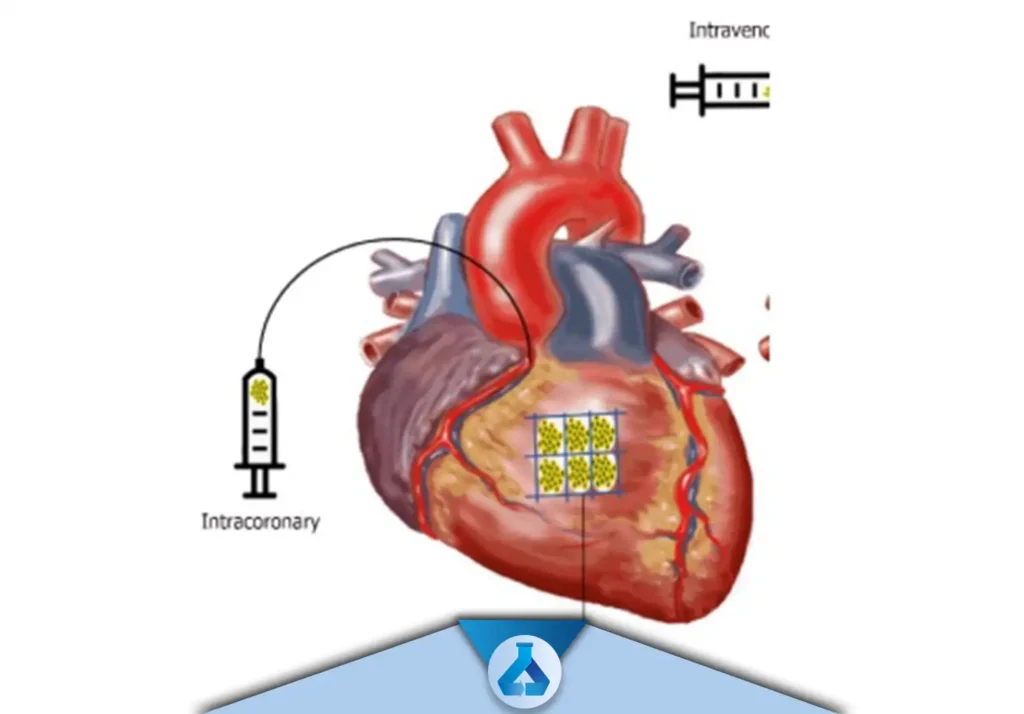
پیوند درون وریدی (Intravenous Transplantation)
مزیت
روش غیر تهاجمی و ساده
معایب
تاثیر پایین در رساندن سلول به بافت
رسیدن تعداد اندک سلول های بنیادی به بافت قلب (گیر افتادن تعداد زیادی از آنها در عروق ریز ریه، طحال و غدد لنفاوی و رسیدن تنها تعداد ناچیزی از سلول ها به عروق کرونر که همین تعداد اندک هم باید از دیواره عروق کرونر عبور کنند تا بتوانند اثر مورد نظر خود را در بافت هدف ایجاد کنند) ← روشی نامناسب برای پیوند سلول های بنیادی
پیوند درون عروق کرونر (Intracoronary Transplantation)
ورورد سلول های بنیادی توسط کانتر آنژیوگرافی به عروق کرونر قلب، سپس عبور از اندوتلیال و ورود به بافت میوکارد
مزیت
روشی کاربردی به دلیل عدم نیاز به جراحی برای پیوند سلول
عیب
پیوند تعداد زیاد سلول با قطر زیاد و ماده تزریقی با ویسکوزیته باال← گرفتگی عروق کرونر ← افزایش بروز انفارکتوس
پیوند درون میوکارد (Intramyocardial Transplantation)
مزایا
روشی مناسب برای پیوند سلول با حجم زیاد، اندازه بزرگ و تعداد بالا
مشاهده ناحیه انفارکتوس و تزریق سلول در حاشیه ناحیه انفارکتوس
میزان باقی ماندن بالای سلول در بافت میوکارد نسبت به دو روش قبل
معایب
نیاز به جراحی/ تنها در بیماران کاندید عمل قلب (گرافت عروقی)
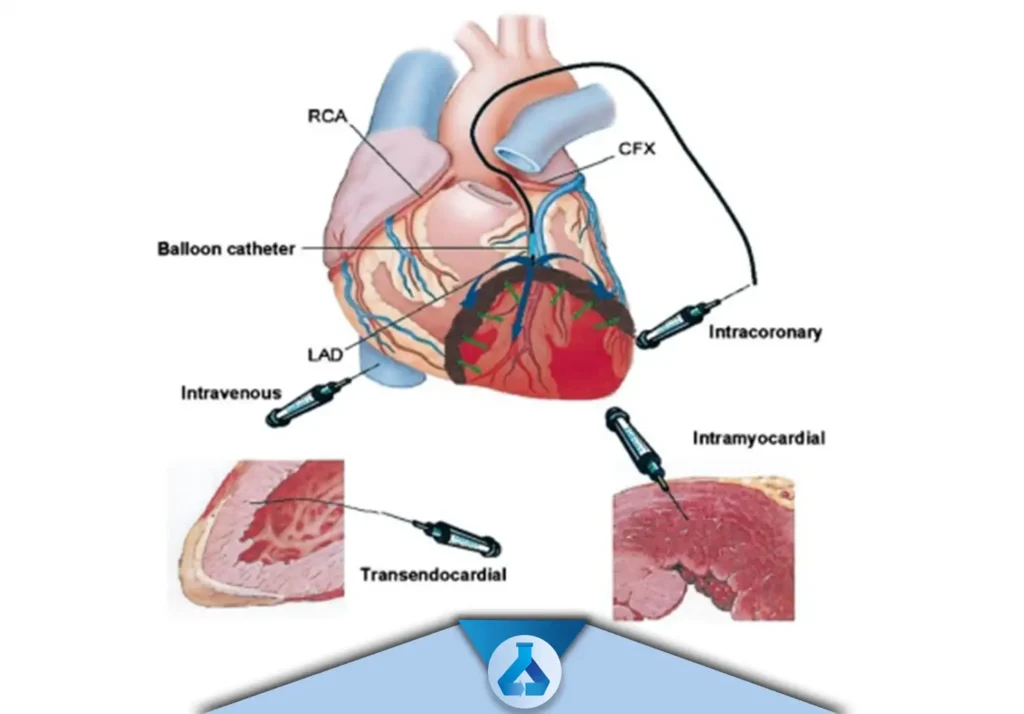
پیوند بوسلیه ی عبور از درون سینوس کرونری (Transcoronary Sinus Transplantation)
ورود سلول ها توسط کانتر آنژیوپالستی به داخل سینوس کرونری و سپس عبور سلول ها از دیواره عروق و رسیدن به بافت
مزیت
عدم نیاز به جراحی/ میزان باقی ماندن سلول در بافت بیشتر از روش پیوند داخل کرونری
عیب
ترد و شکننده بودن سینوس کرونری ← تشدید آسیب قلب
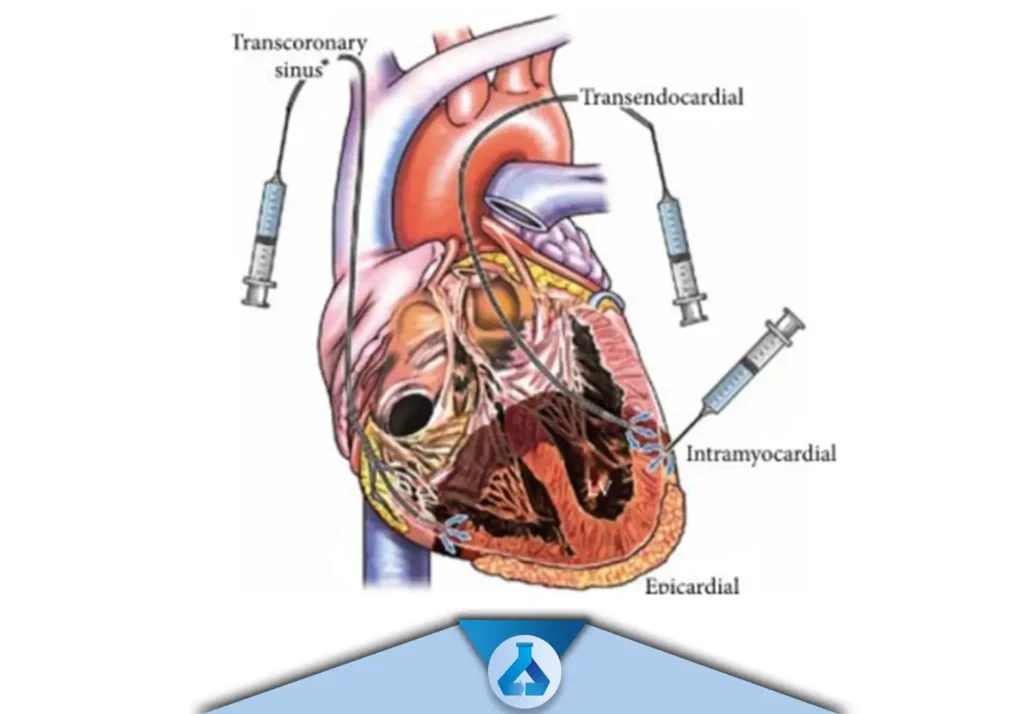
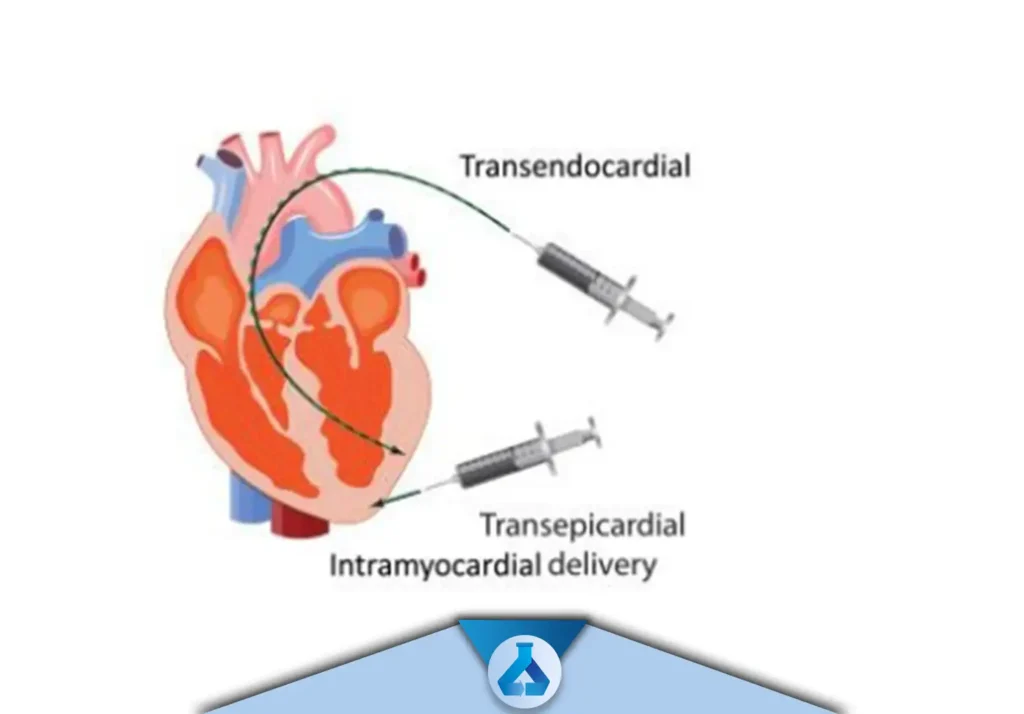
پیوند بوسیله ی عبور از درون اندوکاردیوم (Trancendocardial Transplantation)
مزیت
عدم نیاز به جراحی (پیوند سلول های بنیادی از طریق کانترهای مخصوص به طور مستقیم داخل اندوکارد قلب)
معایب
نیاز به تخصص و مهارت / تجهیزات پیشرفته و گران قیمت همچون mapping electro و سیستم NOGA برای تعیین محل دقیق انفارکتوس

پیوند بوسیله ی عبور از درون اپی کاردیوم (Trancepicardial Transplantation)
مزیت
پیوند مقادیر زیاد سلول
عیب
سلول ها باید از پریکارد احشایی به بافت میوکارد مهاجرت کنند/ اطلاعات ناچیزی در مورد کارایی و اثر بخشی این روش گزارش شده است.
در مهندسی بافت از داربست های مهندسی شده استفاده می کنند که سلول ها را روی این داربست ها قرار می دهند.
داربست ها را می سازند و در محل آسیب دیده قرار می دهند.
سلول هایی از خرگوش گرفته شده سپس گذاشته تا آداپته شوند بعد سلول های چربی و مغز استخوان را از آنها جدا می کنیم بعد به صورت مستقیم بی تمایز یا با تمایز به سلول های قلبی تبدیل می کنیم سرانجام در انفارکتوس پیوند می زنیم.
ارزیابی اثرات پیوند خودی سلول های بنیادی مغز استخوان و بافت چربی تمایز یافته در ترمیم انفارکتوس عضله قلب در خرگوش
- اخذ جداسازی و تمایز سلول های بنیادی به میوسیت های قلب← آماده سازی خرگوش ها برای جراحی← ایجاد مدل تجربی انفارکتوس قلبی از طریق لیگاتور سرخرگ کرونر ← تزریق سلول های بنیادی تمایز یافته در داخل میوکارد (ارزیابی های پاراکلینیکی)
- بررسی اکوکاردیوگرافی: افزایش کسر جهش(EF) ، کوتاه شدگی کسری (FS)و بهبود عملکرد قلبی
- بررسی بافت شناسی: کاهش بافت انفارکت شده
منابع
Alatyyat SM, Alasmari HM, Aleid OA, et al. Umbilical cord stem cells: Background, processing and applications (https://pubmed.ncbi.nlm.nih.gov/32746993/). Tissue Cell. 2020 Aug;65:101351. Accessed 3/22/2023.